Активация ренин-ангиотензин-альдостероновой системы (раас). Ангиотензин-ренин-альдостероновая система: схема, функции и ее роль Ренин ангиотензиновой системы
играет центральную роль в развитии ренальной гипертензии. Любое повреждение паренхимы почек (склероз, кисты, рубцы, микроангиопатические повреждения, тубуло- интерстициальное или гломерулярное воспаление) вызывает нарушение перфузии гломерул и повышает секрецию ренина.
Гиперренинемия ведет к ангиотензин II-зависимой вазоконстрикции, а также альдостерон-зависимой задержке натрия. Таким образом, повышается и общее периферическое сопротивление, и объем циркулирующей крови. У 90% больных с тХПН АГ носит объем- зависимый характер и у 10% ведущим является повышение активности РАС. Кроме того, высокий уровень ангиотензина II запускает процессы воспаления, гипертрофии миокарда, эндотелиального повреждения, пролиферацию мезангиальных клеток и интерстициальный фиброз.
Существенное влияние на объем внеклеточной жидкости и АД оказывает не контролируемое потребление натрия с пищей. Задержка натрия при ХБП может быть обусловлена как снижением СКФ, так и повышением его реабсорбции в канальцах, не зависящим и не зависящим от активации РААС (при гломерулонефритах с нефротическим синдромом).
У детей с АГ на диализе диурез обычно меньше, чем у нормотензивных пациентов того же возраста, а междиализная прибавка веса умеренно коррелирует с междиализным повышением АД (r=0,41). Нефрэктомия у детей на диализе с ренинзависимой АГ снижает среднее АД, а гипертензия приобретает объем-зависимый характер.
Важным механизмом АГ является повышение активности симпатической нервной системы, отмечающееся у больных с ХБП и особенно при ХПН. Лежащие в основе этого феномена механизмы пока не ясны и могут включать афферентные сигналы от почек, допаминергические нарушения и аккумуляцию лептина. Не только блокада b-рецепторов, но и ингибиция ангиотензин- превращающего фермента (АПФ) может уменьшать симпатическую гиперактивацию при ХБП. Представляется, что ренальная ишемия любого происхождения (в том числе локальная) вызывает симпатическую гиперактивацию.
Препараты, используемые в терапии больных при ХБП, могут вызывать ятрогенную артериальную гипертензию. Например, применение эритропоэтина в течение нескольких недель приводит к подъему АД у 20% больных. Глюкокортикоиды вызывают задержку жидкости за счет их минералокортикоидной активности. Циклоспорин А вызывает повышение гломерулярных афферентных артериол и гиперплазии юкстагломерулярного аппарата с последующим повышенным высвобождением ренина и ангиотензина II.
Таким образом, все дети с ХБП находятся в группе риска по развитию АГ. К группе высокого риска относятся больные с тХПН, реципиенты почечного трансплантата, больные с быстропрогрессирующим гломерулонефритом.
Ранняя диагностика АГ представляется чрезвычайно важной задачей для предупреждения отдаленных последствий гипертензии. С этой целью необходимо применение активных скрининговых методов, так как клинические симптомы АГ часто отсутствуют.
Простейшим скрининговым методом выявления АГ является регулярное измерение артериального давления, по меньшей мере, при каждом осмотре пациента врачом. Диагноз АГ правомерен, если не менее чем при 3-х клинических измерениях АД выше 95 перцентиля для данного возраста и роста. (Приложение 1.). В настоящее время широкое распространение получил метод 24-часового (суточного) мониторирования артериального давления (СМАД).
Это исследование позволяет диагностировать «скрытую гипертензию», т.е. не выявляемую при разовых клинических измерениях АД, например, в ночное время, исключить гипертензию «белого халата», которая встречается даже у детей, длительно находящихся в стационаре. В последнем случае целесообразно проведение СМАД амбулаторно, когда ребенок на протяжении исследования находится в привычной ему домашней обстановке.
Проведение СМАД показано всем детям с ХБП ежегодно. В случае выявления АГ необходимо также проведение офтальмологического осмотра (для оценки состояния сосудов сетчатки) и эхокардиографии (для исключения систолической и диастолической дисфункции, оценки степени гипертрофии миокарда). В дальнейшем эти исследования должны выполняться не реже 1 раза в год.
Основной целью антигипертензивной терапии является предупреждение повреждения органов-мишеней (особенно гипертрофии левого желудочка) и замедление прогрессирования ХБП. Всем детям с ХБП, осложненной АГ, показана антигипертензивная терапия до достижения уровня АД ниже 90 перцентиля для данного возраста и роста.
Терапия АГ включает в себя коррекцию образа жизни и диеты и медикаментозное лечение.
В рационе детей с ХБП, осложненной АГ, прежде всего, необходимо ограничить потребление натрия до 1-2 г/сут. Пища готовится без добавления соли, которая выдается дозировано для досаливания еды в тарелке, должны быть исключены все продукты с высоким содержанием натрия (консервы, колбасные изделия, ржаной хлеб и т.п.). Такого рода ограничения часто тяжело переносятся пациентами, но, неконтролируемое потребление натрия значительно снижает эффективность медикаментозной антигипертензивной терапии.
Ожирение не характерно для детей с ХБП и обычно связано с лечением стероидами. Постепенное снижение массы тела на фоне низкокалорийной диеты и дозированных физических нагрузок способствует нормализации АД. На практике применение низкокалорийной диеты затруднено из-за уже имеющихся у детей с ХБП диетических ограничений, и она редко оказывается эффективной. Тем не менее, у тучных детей с задержкой натрия может быть полезна комбинированная низкокалорийная диета с пониженным содержанием натрия.
У больных с АГ, получающих ЗПТ, изменение диализного режима может улучшить контроль АД до начала фармакологического лечения. В большинстве случаев, у диализных больных можно добиться нормализации показателей АД адекватной продолжительностью диализа, тщательным контролем баланса внеклеточной жидкости, более агрессивным достижением сухого веса. Считается, что сокращение натрия в диете в сочетании с низким натрием в диализате сравнимо по эффективности с увеличением диализного времени и позволяет добиться умеренного снижения АД.
На всех стадиях ХБП основой антигипертензивной терапии является фармакологическое лечение. Контроль АД ниже 90 перцентиля может быть достигнут монотерапией не более чем у 75% детей с ХБП 2-ой стадии. У остальных больных необходимо применение 2-х и более лекарственных препаратов. У детей с тХПН трудно достичь адекватного контроля АД, у 50% детей на диализе наблюдается неконтролируемая гипертензия.
У детей с АГ рекомендуется начинать лечение с одного препарата в низкой или средней терапевтической дозе и постепенно повышать ее до достижения контроля АД. При отсутствии достаточного эффекта от монотерапии показано использование комбинации из 2-х и более препаратов. Исключение - неотложные состояния при АГ, такие как гипертонический криз, гипертоническая энцефалопатия, когда лечение следует начинать с внутривенного введения препаратов до достижения клинического эффекта.
В настоящее время в терапии артериальной гипертензии используется широкий спектр лекарственных средств (Табл.2.1).
В первую очередь применяются препараты следующих групп:
· Ингибиторы ангиотензин-превращающего фермента (иАПФ)
· Блокаторы рецепторов к ангиотензину II (БРА)
· Блокаторы кальциевых каналов
· β - адреноблокаторы
· диуретики
К препаратам резерва относятся:
· α β – адреноблокаторы
· центральные α – антагонисты
· периферические α - антагонисты
· периферические вазодилататоры.
У детей с хронической патологией почек начинать терапию наиболее целесообразно с иАПФ или БРА. Эти препараты не только обладают гипотензивным действием, но и замедляют прогрессирование почечной недостаточности более эффективно, чем препараты других фармакологических групп. Ренопротективный эффект блокады РААС обусловлен снижением внутриклубочковой гипертензии путем избирательной дилатации эфферентной артериолы, снижением протеинурии, а также ослаблением провоспалительного и просклеротического действия ангиотензина II. Дополнительный эффект блокады РААС заключается в снижении симпатической гиперактивности.
Поскольку протеинурия является независимым фактором прогрессирования ХБП, пациенты с ХБП и протеинурией должны получать блокаторы РААС даже при отсутствии АГ. Не выявлено отчетливых преимуществ применения БРА перед иАПФ. Если протеинурия сохраняется на фоне монотерапии, то возможно применение комбинации иАПФ и БРА, так как это сочетание эффективно для уменьшения протеинурии и замедления прогрессирования ХБП.
Применение ингибиторов АПФ и БРА противопоказано пациентам со снижением СКФ ≤ 20 мл/мин, при гиперкалиемии, и при двустороннем стенозе почечных артерий. При назначении препаратов этих групп детям с ХБП 3-4 стадии необходимо контролировать уровень азотемии и калия после начала терапии и при каждом повышении дозы. Терапия комбинацией иАПФ и БРА повышает риск падения клубочковой фильтрации и гиперкалиемии. У детей с ХПН целесообразным может быть применение фозиноприла (моноприла), т.к. этот препарат (в отличие от других и АПФ) метаболизируется в основном в печени, а не выводится с мочой и более безопасен для больных с существенным нарушением почечных функций. Отмечено, что кашель, индуцированный иАПФ, у детей встречается реже, чем у взрослых; при возникновении этого побочного эффекта возможна замена иАПФ на БРА.
b-блокаторы – препараты второй линии для лечения детей с почечной гипертензией. b-блокаторы должны с осторожностью использоваться при сердечной недостаточности, а также у больных сахарным диабетом из-за негативных метаболических эффектов. Неселективные b-блокаторы противопоказаны при заболеваниях легких, сопровождающихся бронхообструкцией. У грудных детей хороший эффект оказывает назначение пропранолола. Ретардированная форма этого препарата позволяет назначать его 1 раз в день у старших детей. Предпочтительнее назначение селективных b1-блокаторов, например атенолола, который также обладает пролонгированным действием.
Применение b-блокаторов показано при наличии симптомов гиперактивации симпатической нервной системы: тахикардии, вазоконстрикции, высокого сердечного.
Блокаторы кальциевых каналов (БКК) используются как дополнительная терапия у детей с резистентной гипертензией. Дигидропиридиновые препараты (нифедипин, амлодипин и т.д.) действуют главным образом как вазодилататоры. Дозы амлодипина разработаны для педиатрии и не требуют коррекции в зависимости от почечной функции, однако дигидропиридиновые БКК (нифедипин) повышают внутриклубочковое давление и могут повышать протеинурию, не оказывая, следовательно, ренопротективного действия. Недигидропиридиновые БКК (производные фенилалкиламина - верапамил, бензодиазепина - дилтиазем) обладают дополнительным антипротеин- урическим эффектом.
В исследованиях у пожилых больных с сахарным диабетом 2 типа, недигдропиридиновые БКК показали себя как действенное средство в снижении протеинурии и АД и замедлении прогрессирование ХБП, их эффективность в этом отношении оказалась сравнима с иАПФ - лизиноприлом. Поскольку среди детей подобных исследований не проводилось, в детском возрасте недигдропиридиновые БКК должны применяться с осторожностью, учитывая их побочные эффекты (удлинение интервала PQ, брадиаритмии).
В исследованиях у больных с сахарным диабетом, АГ и протеинурией комбинация иАПФ с дигидропиридиновым БКК III поколения – манидипином - оказывала дополнительный антипротеинурический эффект по сравнению с монотерапией иАПФ. Показано благоприятное воздействие манидипина на почечную гемодинамику и протеинурию.
Внутривенное введение никардипина является методом выбора для лечения гипертонического криза, особенно в тех случаях, когда почечная функция не известна или быстро изменяется. Этот препарат может безопасно использоваться даже у очень маленьких детей с АГ.
Диуретики показаны, прежде всего, пациентам с задержкой натрия, гиперволемией и отеками и не являются препаратами первой линии в терапии АГ у детей с ХБП. Необходимо помнить, что тиазидные диуретики становятся малоэффективными при СКФ
Ренин-ангиотензин-альдостероновая система (РААС) выполняет важное гуморальное влияние на сердечно-сосудистую систему и участвует в регуляции артериального давления. Центральным звеном РААС является ангиотензин II (АТ II) (схема 1), который обладает мощным прямым вазоконстрикторным действием преимущественно на артерии и опосредованным действием на ЦНС, высвобождением катехоламинов из надпочечников и вызывает увеличение ОПСС, стимулирует секрецию альдостерона и приводит к задержке жидкости и повышению (ОЦК), стимулирует выброс катехоламинов (норадренолина) и других нейрогормонов из симпатических окончаний. Влияние АТ II на уровень АД осуществляется за счет действия на тонус сосудов, а также посредством структурной перестройки и ремоделирования сердца и сосудов. В частности, ATII является также фактором роста (или модулятором роста) для кардиомиоцитов и гладкомышечных клеток сосудов.
Схема 1. Строение ренин-ангиотензин-альдостероновой системы
Функции других форм ангиотензина. Ангиотензин I малозначим в системе РААС, так как быстро превращается в АТП, кроме того, его активность в 100 раз меньше активности АТП. Ангиотензин III действует подобно АТП, но его прессорная активность в 4 раза слабее АТП. Ангиотензин 1-7 образуется вследствие превращения ангиотензина I. По функциям он значительно отличается от АТП: он не вызывает прессорного действия, а наоборот, приводит к снижению АД благодаря секреции АДГ, стимуляции синтеза простагландинов, натрийуреза.
РААС оказывает регулирующее влияние на почечную функцию. АТП вызывает мощный спазм приносящей артериолы и снижение давления в капиллярах клубочка, уменьшение фильтрации в нефроне. В результате снижения фильтрации уменьшается реабсорбция натрия в проксимальном отделе нефрона, что приводит к увеличению концентрации натрия в дистальных канальцах и активации Na-чувствительных рецепторов плотного пятна в нефроне. По меха-низму обратной связи это сопровождается торможением выделения ренина и увеличением скорости клубочковой фильтрации.
Функционирование РААС связано с альдостероном и посредством механизма обратной связи. Альдостерон - важнейший регулятор объема внеклеточной жидкости и гомеостаза калия. Прямого действия на секрецию ренина и АТП альдостерон не оказывает, но возможно косвенное влияние через задержку натрия в организме. В регуляции секреции альдостерона участвуют АТП и электролиты, причем АТП - стимулирует, а натрий и калий - уменьшают его образование.
Гомеостаз электролитов тесно связан с активностью РААС. Натрий и калий не только влияют на активность ренина, но и изменяют чувствительность тканей к АТП. При этом в регуляции активности ренина большая роль принадлежит натрию, а в регуляции секреции альдостерона - калий и натрий имеют одинаковые влияния.
Физиологическая активация РААС наблюдается при потере натрия и жидкости, значительном снижении АД, сопровождающемся падением фильтрационного давления в почках, повышении активности симпатической нервной системы, а также под воздействием многих гуморальных агентов (вазопрессина, предсердного натрийуретического гормона, антидиуретического гормона).
Целый ряд сердечно-сосудистых заболеваний может способствовать патологической стимуляции РААС, в частности, при АГ, застойной сердечной недостаточности, остром инфаркте миокарда.
В настоящее время известно, что РАС функционирует не только в плазме (эндокринная функция), но и во многих тканях (головном мозге, сосудистой стенке, сердце, почках, надпочечниках, легких). Эти тканевые системы могут работать независимо от плазменной, на клеточном уровне (паракринная регуляция). Поэтому различают краткосрочные эффекты ATII, обусловленные свободно циркулирующей его фракцией в системном кровотоке, и отсроченные эффекты, регулируемые через тканевые РАС и влияющие на структурно-адаптационные механизмы поражения органов.
Ключевым ферментом РААС является ангиотензин-превращающий фермент (АПФ), он обеспечивает превращение ΑTI в ATII. Основное количество АПФ присутствует в системном кровотоке, обеспечивая образование циркулирующего АТII и краткосрочные геодинамические эффекты. Превращение АТ в ATII в тканях может осуществляться не только с помощью АПФ, но и другими ферментами (химазы, эндопероксиды, катепсин G и др.); считают, что им принадлежит ведущая роль в функционировании тканевых РАС и развитии длительных эффектов моделирования функции и структуры органов-мишеней.
АПФ идентичен ферменту кининазе II, участвующему в деградации брадикинина. Брадикинин - мощный вазодилататор, участвующий в регуляции микроциркуляции и ионном транспорте. Брадикинин имеет очень короткий период жизни и присутствует в кровотоке (тканях) в низких концентрациях; поэтому он проявлят свои эффекты как местный гормон (паракринно). Брадикинин способствует увеличению внутриклеточного Са 2 +, являющегося кофактором для NO-синтетазы, участвующей в образовании эндотелийрелаксирующего фактора (оксида азота или NO). Эндотелийрелаксирующий фактор, блокирующий сокращение мускулатуры сосудов и агрегацию тромбоцитов, является также ингибитором митоза и пролиферации гладкой мускулатуры сосудов, что обеспечивает антиатерогенное действие. Брадикинин также стимулирует синтез в эндотелии сосудов ПГЕ2 и ПГI2 (простациклина) - мощных вазодилататоров и тромбоцитарных антиагрегантов.
Таким образом, брадикинин и вся кининовая система являются противодействующей для РААС. Блокирование АПФ потенциально повышает уровень кининов в тканях сердца и сосудистой стенки, что обеспечивает антипролиферативный, антиишемический, антиатерогенный и антиагрегантный эффекты. Кинины способствуют увеличению кровотока, диуреза и натрийуреза без существенного изменения скорости клубочковой фильтрации. ПГ Е2 и ПГI2 также обладают диуретическим и натрийуретическим действием и увеличивают почечный кровоток.
Для цитирования:
Леонова М.В. Новые и перспективные лекарственные препараты, блокирующие ренин-ангиотензин-альдостероновую систему // РМЖ. Медицинское обозрение. 2013. №17. С. 886
Роль ренин-ангиотензин-альдостероновой системы (РААС) в развитии артериальной гипертонии (АГ) и других сердечно-сосудистых заболеваний в настоящее время считается главенствующей. В кардиоваскулярном континууме АГ находится среди факторов риска, а главным патофизиологическим механизмом поражения сердечно-сосудистой системы является ангиотензин II (АТII). АТII является ключевым компонентом РААС - эффектором, который реализует вазоконстрикцию, задержку натрия, активацию симпатической нервной системы, клеточную пролиферацию и гипертрофию, развитие оксидативного стресса и процессов воспаления сосудистой стенки.
В настоящее время уже получили развитие и широкое клиническое применение два класса препаратов, блокирующих РААС, - ингибиторы АПФ и блокаторы рецепторов АТII. Фармакологические и клинические эффекты этих классов имеют отличия. АПФ является пептидазой из группы цинк-металлопротеиназ, которая метаболизирует АТI, АТ1-7, брадикинин, субстанцию Р и многие другие пептиды . Механизм действия ингибиторов АПФ главным образом связан с предотвращением образования АТII, что способствует вазодилатации, натрийурезу и устраняет провоспалительный, пролиферативный и другие эффекты АТII. Кроме того, ингибиторы АПФ препятствуют деградации брадикинина и повышают его уровень. Брадикинин - мощный вазодилататор, он потенцирует натрийурез, а главное - обладает кардиопротективным (предотвращает гипертрофию, уменьшает ишемическое повреждение миокарда, улучшает коронарное кровоснабжение) и вазопротективным действием, улучшая эндотелиальную функцию. Вместе с тем, высокий уровень брадикинина - причина развития ангионевротического отека, что является одним из серьезных недостатков ингибиторов АПФ, которые значительно повышают уровень кининов.
Ингибиторам АПФ не всегда удается полностью блокировать образование АТII в тканях. В настоящее время установлено, что в его превращении в тканях могут участвовать и другие ферменты, не связанные с АПФ, прежде всего эндопептидазы, на которые действие ингибиторов АПФ не распространяется. В результате ингибиторы АПФ не могут полностью устранить эффекты АТII, что может быть причиной их недостаточной эффективности.
Решению этой проблемы способствовало открытие рецепторов АТII и первого класса препаратов, селективно блокирующих АТ1-рецепторы. Через АТ1-рецепторы реализуются неблагоприятные эффекты АТII: вазоконстрикция, секреция альдостерона, вазопрессина, норадреналина, задержка жидкости, пролиферация гладкомышечных клеток и кардиомиоцитов, активация САС, а также механизм отрицательной «обратной связи» - образование ренина. АТ2-рецепторы выполняют «полезные» функции, такие как вазодилатация, процессы репарации и регенерации, антипролиферативное действие, дифференцировка и развитие эмбриональных тканей. Клинические эффекты блокаторов рецепторов АТII опосредованы через устранение «вредных» эффектов АТII на уровне АТ1-рецепторов, что обеспечивает более полное блокирование неблагоприятных эффектов АТII и усиление влияния АТII на АТ2-рецепторы, что дополняет вазодилатирующий и антипролиферативный эффекты. Блокаторы рецепторов АТII обладают специфичным действием на РААС, не вмешиваясь в кининовую систему. Отсутствие влияния на активность кининовой системы, с одной стороны, уменьшает выраженность нежелательных эффектов (кашель, ангионевротический отек), но, с другой, лишает блокаторы рецепторов АТII важного антиишемического и вазопротективного действия, что отличает их от ингибиторов АПФ. По этой причине показания к применению блокаторов рецепторов АТII в большинстве повторяют показания к назначению ингибиторов АПФ, делают их альтернативными препаратами.
Несмотря на внедрение блокаторов РААС в широкую практику лечения АГ, проблемы улучшения исходов и прогноза остаются. К ним относятся: возможность улучшения контроля АД в популяции, эффективность лечения резистентной АГ, возможности дальнейшего снижения риска сердечно-сосудистых заболеваний.
Поиск новых путей воздействия на РААС активно продолжается; изучаются другие тесно взаимодействующие системы и создаются препараты с множественным механизмом действия, такие как ингибиторы АПФ и нейтральной эндопептидазы (НЭП), ингибиторы эндотелин-превращающего фермента (ЭПФ) и НЭП, ингибиторы АПФ/НЭП/ЭПФ .
Ингибиторы вазопептидаз
К вазопептидазам кроме известного АПФ относятся еще 2 других цинк-металлопротеиназы - неприлизин (нейтральная эндопептидаза, НЭП) и эндотелин-превращающий фермент, которые также могут быть мишенями для фармакологического воздействия.
Неприлизин - фермент, вырабатываемый эндотелием сосудов и участвующий в деградации натрийуретического пептида, а также брадикинина.
Система натрийуретического пептида представлена тремя разными изоформами: предсердным натрий-уретическим пептидом (А-тип), мозговым натрийуретическим пептидом (В-тип), которые синтезируются в предсердии и миокарде, и эндотелиальным С-пептидом, которые по своим биологическим функциям являются эндогенными ингибиторами РААС и эндотелина-1 (табл. 1) . Кардиоваскулярные и ренальные эффекты натрийуретического пептида заключаются в снижении АД через влияние на сосудистый тонус и водноэлектролитный баланс, а также в антипролиферативном и антифибротическом действии на органы-мишени. По самым последним данным, система натрийуретического пептида участвует в метаболической регуляции: окислении липидов, образовании и дифференцировке адипоцитов, активации адипонектина, секреции инсулина и толерантности к углеводам, что может обеспечивать защиту от развития метаболического синдрома .
К настоящему времени стало известно, что развитие сердечно-сосудистых заболеваний ассоциируется с дизрегуляцией системы натрийуретического пептида. Так, при АГ наблюдается дефицит натрийуретического пептида, приводящий к солечувствительности и нарушению натрийуреза; при хронической сердечной недостаточности (ХСН) на фоне дефицита наблюдается аномалия функционирования гормонов системы натрийуретического пептида .
Поэтому для потенцирования системы натрийуретического пептида с целью достижения дополнительного гипотензивного и протективных кардиоренальных эффектов возможно применение ингибиторов НЭП. Ингибирование неприлизина приводит к потенцированию натрийуретического, диуретического и вазодилатирующего эффектов эндогенного натрийуретического пептида и в результате - к снижению АД. Однако НЭП участвует в деградации и других вазоактивных пептидов, в частности АТI, АТII и эндотелина-1. Поэтому баланс эффектов воздействия на сосудистый тонус ингибиторов НЭП вариабельный и зависит от преобладания констрикторных и дилатирующих влияний. При длительном применении антигипертензивное действие ингибиторов неприлизина выражено слабо вследствие компенсаторной активации образования АТII и эндотелина-1 .
В этой связи сочетание эффектов ингибиторов АПФ и ингибиторов НЭП может существенно потенцировать гемодинамические и антипролиферативные эффекты в результате комплементарного механизма действия, что привело к созданию препаратов с двойным механизмом действия, объединенных названием - ингибиторы вазопептидаз (табл. 2, рис. 1) .
Известные ингибиторы вазопептидаз характеризуются разной степенью селективности к НЭП/АПФ: омапатрилат - 8,9:0,5; фазидоприлат - 5,1:9,8; сампатрилат - 8,0:1,2 . В результате ингибиторы вазопептидаз получили гораздо большие возможности в достижении гипотензивного эффекта вне зависимости от активности РААС и уровня задержки натрия и в органопротекции (регресс гипертрофии, альбуминурии, жесткости сосудов). Наиболее изученным в клинических исследованиях был омапатрилат, который показал более высокую гипотензивную эффективность в сравнении с ингибиторами АПФ, а у пациентов с ХСН приводил к увеличению фракции выброса и улучшению клинических исходов (исследования IMPRESS, OVERTURE), но без преимуществ перед ингибиторами АПФ .
Однако в крупных клинических исследованиях с применением омапатрилата была установлена более высокая частота развития ангионевротического отека в сравнении с ингибиторами АПФ. Известно, что частота развития ангионевротического отека при использовании ингибиторов АПФ составляет от 0,1 до 0,5% в популяции, из них 20% случаев являются жизнеугрожающими, что связано с многократным повышением концентраций брадикинина и его метаболитов . Результаты крупного многоцентрового исследования OCTAVE (n=25 302), которое было специально спланировано для изучения частоты развития ангионевротического отека, показало, что частота развития этого побочного эффекта на фоне лечения омапатрилатом превышает таковую в группе эналаприла - 2,17% против 0,68% (относительный риск 3,4) . Это объяснялось усилением влияния на уровень кининов при синергичном ингибировании АПФ и НЭП, связанным с ингибированием аминопептидазы Р, участвующей в деградации брадикинина .
Новый двойной ингибитор вазопептидаз, блокирующий АПФ/НЭП, - илепатрил, который имеет более высокую аффинность к АПФ в сравнении с НЭП . При изучении фармакодинамических эффектов илепатрила по влиянию на активность РААС и натрийуретического пептида у здоровых добровольцев было установлено, что препарат дозозависимо (в дозах 5 и 25 мг) и значимо (более 88%) подавляет АПФ в плазме крови продолжительностью более 48 ч вне зависимости от солечувствительности. Одновременно препарат значимо повышал активность ренина плазмы в течение 48 ч и уменьшал уровень альдостерона . Эти результаты показали выраженное и более продолжительное подавление РААС в отличие от ингибитора АПФ рамиприла в дозе 10 мг, что объяснялось более значимым тканевым действием илепатрила на АПФ и большей аффинностью к АПФ, и сопоставимую степень блокады РААС в сравнении с комбинацией 150 мг ирбесартана + 10 мг рамиприла. В отличие от действия на РААС, эффект илепатрила на натрийуретический пептид проявлялся кратковременным увеличением уровня его экскреции в период 4-8 ч после приема дозы 25 мг, что свидетельствует о меньшей и слабой аффинности к НЭП и отличает его от омапатрилата. Причем по уровню экскреции электролитов дополнительного натрийуретического действия в сравнении с рамиприлом или ирбесартаном у препарата нет, как впрочем, и у других ингибиторов вазопептидаз. Максимальное гипотензивное действие развивается через 6-12 ч после приема препарата, и снижение среднего АД составляет 5±5 и 10±4 мм рт.ст. при низкой и высокой солечувствительности соответственно . По фармакокинетическим характеристикам илепатрил представляет собой пролекарство с активным метаболитом, который быстро образуется с достижением максимальной концентрации через 1-1,5 ч и медленно элиминирует. В настоящее время проводятся клинические исследования III фазы.
Альтернативный путь к двойному подавлению РААС и НЭП представлен сочетанием блокады рецепторов АТII и НЭП (рис. 2) . Блокаторы рецепторов АТII не влияют на метаболизм кининов в отличие от ингибиторов АПФ, поэтому потенциально имеют меньший риск развития ангионевротических осложнений. В настоящее время проходит фазу III клинических исследований первый препарат - блокатор рецепторов АТII с эффектом ингибирования НЭП в соотношении 1:1 - LCZ696. Объединенная молекула препарата содержит валсартан и ингибитор НЭП (AHU377) в форме пролекарства . В крупном исследовании у больных с АГ (n=1328) препарат LCZ696 в дозах 200-400 мг показал преимущество в гипотензивном эффекте перед валсартаном в дозах 160-320 мг в виде дополнительного снижения АД на 5/3 и 6/3 мм рт.ст. . Гипотензивный эффект LCZ696 сопровождался более выраженным снижением пульсового АД: на 2,25 и 3,32 мм рт.ст. соответственно в дозах 200 и 400 мг, что в настоящее время рассматривается как положительный прогностический фактор по влиянию на жесткость сосудистой стенки и сердечно-сосудистые исходы. При этом изучение нейрогуморальных биомаркеров на фоне лечения LCZ696 показало увеличение уровня натрийуретического пептида при сопоставимой степени увеличения уровня ренина и альдостерона в сравнении с валсартаном. Переносимость у больных с АГ была хорошей, и случаев ангионевротического отека не было отмечено. В настоящее время завершено исследование PARAMOUMT у 685 пациентов с ХСН и ненарушенной ФВ . Результаты исследования показали, что LCZ696 быстрее и выраженнее снижает уровень NT-proBNP (первичная конечная точка - маркер повышения активности натрий-уретического пептида и неблагоприятного прогноза при ХСН) в сравнении с валсартаном, а также уменьшает размеры левого предсердия, что свидетельствует о регрессе его ремоделирования . Исследование у пациентов с ХСН и сниженной ФВ продолжается в настоящее время (исследование PARADIGM-HF).
Ингибиторы системы эндотелина
Система эндотелина играет важную роль в регуляции сосудистого тонуса и регионального кровотока. Среди трех известных изоформ эндотелин-1 является наиболее активным. Кроме известных вазоконстрикторных эффектов эндотелин стимулирует пролиферацию и синтез межклеточного матрикса, а также вследствие прямого воздействия на тонус почечных сосудов участвует в регуляции водно-электролитного гомеостаза. Эффекты эндотелина реализуются через взаимодействие со специфическими рецепторами А-типа и В-типа, функции которых взаимопротивоположны: через А-тип рецепторов происходит вазоконстрикция, а через В-тип - вазодилатация . В последние годы установлено, что рецепторы В-типа играют большую роль в клиренсе эндотелина-1, т.е. при блокаде этих рецепторов нарушается рецепторзависимый клиренс эндотелина-1 и увеличивается его концентрация . Кроме того, рецепторы В-типа участвуют в регуляции почечных эффектов эндотелина-1 и поддержании водно-электролитного гомеостаза, что имеет важное значение.
В настоящее время роль эндотелина доказана в развитии ряда заболеваний, в т.ч. АГ, ХСН, легочной гипертензии, хронических заболеваний почек; показана тесная связь между уровнем эндотелина и метаболическим синдромом, дисфункцией эндотелия и атерогенезом. С 1990-х гг. ведется поиск антагонистов рецепторов эндотелина, пригодных для клинического использования; уже известно 10 препаратов («сентаны») с разной степенью селективности к А/B-типу рецепторов . Первый неселективный антагонист рецепторов эндотелина - бозентан - в клиническом исследовании у больных с АГ показал гипотензивную эффективность, сопоставимую с таковой ингибитора АПФ эналаприла . Дальнейшие исследования эффективности применения антагонистов эндотелина при АГ показали их клиническую значимость в лечении резистентной АГ и при высоком сердечно-сосудистом риске. Эти данные были получены в двух крупных клинических исследованиях DORADO (n=379) и DORADO-АС (n=849), в которых пациентам с резистентной АГ добавлялся дарусентан к тройной комбинированной терапии . В исследовании DORADO у пациентов резистентная АГ сочеталась с хронической болезнью почек и протеинурией, в результате добавления дарусентана наблюдалось не только значительное снижение АД, но и уменьшение экскреции белка. Антипротеинурический эффект антагонистов рецепторов эндотелина был в последующем подтвержден в исследовании у пациентов с диабетической нефропатией при использовании авосентана . Однако в исследовании DORADO-АС преимуществ в дополнительном снижении АД перед препаратами сравнения и плацебо не было выявлено, что послужило поводом к прекращению дальнейших исследований. Кроме того, в 4 крупных исследованиях антагонистов эндотелина (бозентана, дарусентана, энрасентана) у пациентов с ХСН были получены противоречивые результаты, что объяснялось увеличением концентрации эндотелина-1 . Дальнейшее изучение антагонистов рецепторов эндотелина было приостановлено ввиду нежелательных эффектов, связанных с задержкой жидкости (периферические отеки, перегрузка объемом). Развитие этих эффектов связывают с воздействием антагонистов эндотелина на В-тип рецепторов, что изменило поиск препаратов, влияющих на систему эндотелина через другие пути; а антагонисты рецепторов эндотелина в настоящее время имеют только одно показание - лечение легочной гипертензии.
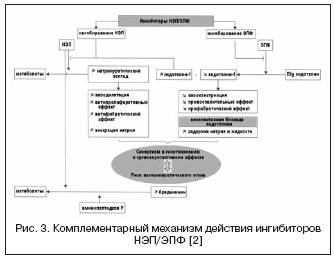
С учетом высокой значимости системы эндотелина в регуляции сосудистого тонуса ведется поиск другого механизма воздействия через вазопептидазу - ЭПФ, участвующий в образовании активного эндотелина-1 (рис. 3) . Блокирование ЭПФ и сочетание с ингибированием НЭП позволяют эффективно подавлять образование эндотелина-1 и потенцировать эффекты натрий-уретического пептида. Преимущества двойного механизма действия заключаются, с одной стороны, в предупреждении недостатков ингибиторов НЭП, связанных с возможной вазоконстрикцией, опосредованной активацией эндотелина, с другой, натрийуретическая активность ингибиторов НЭП позволяет компенсировать задержку жидкости, связанную с неселективной блокадой эндотелиновых рецепторов. Даглутрил является двойным ингибитором НЭП и ЭПФ, который находится во II фазе клинических исследований . В исследованиях показаны выраженные кардиопротективные эффекты препарата благодаря уменьшению ремоделирования сердца и сосудов, регрессу гипертрофии и фиброза.
Прямые ингибиторы ренина
Известно, что ингибиторы АПФ и блокаторы рецепторов АТII по механизму обратной связи повышают активность ренина, что является причиной ускользания эффективности блокаторов РААС. Ренин представляет собой самый первый этап каскада РААС; он вырабатывается юкстагломерулярными клетками почек. Ренин через ангиотензиноген способствует образованию АТII, вазоконстрикции и секреции альдостерона, а также регулирует механизмы обратной связи. Поэтому ингибирование ренина позволяет достичь более полной блокады системы РААС. Поиск ингибиторов ренина ведется с 1970-х гг.; долгое время не удавалось получить пер-оральную форму ингибиторов ренина ввиду их низкой биодоступности в ЖКТ (менее 2%). Первый прямой ингибитор ренина, пригодный для перорального применения, - алискирен - был зарегистрирован в 2007 г. Алискирен имеет низкую биодоступность (2,6%), большой период полувыведения (24-40 ч), внепочечный путь элиминации . Фармакодинамика алискирена связана с 80% уменьшением уровня АТII. В клинических исследованиях у пациентов с АГ алискирен в дозах 150-300 мг/сут приводил к снижению САД на 8,7-13 и 14,1-15,8 мм рт.ст. соответственно и ДАД - на 7,8-10,3 и 10,3-12,3 мм рт.ст. . Гипотензивный эффект алискирена наблюдался в разных подгруппах пациентов, включая больных с метаболическим синдромом, ожирением; по выраженности он был сопоставим с эффектом ингибиторов АПФ, блокаторов рецепторов АТII, а также отмечен аддитивный эффект в комбинации с валсартаном, гидрохлоротиазидом и амлодипином. В ряде клинических исследований были показаны органопротективные эффекты препарата: антипротеинурический эффект у пациентов с диабетической нефропатией (исследование AVOID, n=599) , регресс гипертрофии левого желудочка у пациентов с АГ (исследование ALLAY, n=465) . Так, в исследовании AVOID после 3-месячного лечения лозартаном в дозе 100 мг/сут и достижения целевого уровня АД (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
Кроме того, проводится серия клинических исследований алискирена при лечении других сердечно-сосудистых заболеваний с оценкой влияния на прогноз больных: исследования ALOFT (n=320), ASTRONAUT (n=1639), ATMOSPHERE (n=7000) у пациентов с ХСН, исследование ALTITUDE у пациентов с сахарным диабетом и высоким сердечно-сосудистым риском, исследование ASPIRE у пациентов с постинфарктным ремоделированием.
Заключение
Для решения проблем предупреждения сердечно-сосудистых заболеваний продолжается создание новых лекарственных препаратов со сложным множественным механизмом действия, позволяющих обеспечивать более полную блокаду РААС через каскад механизмов гемодинамической и нейрогуморальной регуляции. Потенциальные эффекты таких препаратов позволяют не только обеспечивать дополнительный гипотензивный эффект, но и достигать контроля уровня АД у пациентов высокого риска, включая резистентную форму АГ. Лекарственные препараты с множественным механизмом действия демонстрируют преимущества в более выраженном органопротективном действии, что позволит предупреждать дальнейшее поражение сердечно-сосудистой системы. Изучение преимуществ новых препаратов, блокирующих РААС, требует дальнейших исследований и оценки их влияния на прогноз больных с АГ и другими сердечно-сосудистыми заболеваниями.



Литература
1. Campbell D.J. Vasopeptidase inhibition: a doubleedged sword? // Hypertension. 2003. Vol. 41. P. 383-389.
2. Laurent S., Schlaich M., Esler M. New drugs, procedures, and devices for hypertension // Lancet. 2012. Vol. 380. P. 591-600.
3. Corti R., Burnett J.C., Rouleau J.L. et al. Vasopeptidase inhibitors: a new therapeutic concept in cardiovascular disease? // Circulation. 2001. Vol. 104. P. 1856-1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. et al. Neutral endopeptidase inhibition and the natriuretic peptide system: an evolving strategy in cardiovascular therapeutics // Eur. Heart J. 2012, doi:10.1093/eurheartj/ehs262.
5. Rouleau J.L., Pfeffer M.A., Stewart D.J. et al. Comparison of vasopeptidase inhibitor, omapatrilat, and lisinopril on exercise tolerance and morbidity in patients with heart failure: IMPRESS randomised trial // Lancet. 2000. Vol. 356. P. 615-620.
6. Packer M., Califf R.M., Konstam M.A. et al. Comparison of omapatrilat and enalapril in patients with chronic heart failure: The Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE) // Circulation. 2002. Vol. 106. P. 920-926.
7. Warner K.K., Visconti J.A., Tschampel M.M. Angiotensin II receptor blockers in patients with ACE inhibitor-induced angioedema // Ann. Pharmacother. 2000. Vol. 34. P. 526-528.
8. Kostis J.B., Packer M., Black H.R. et al. Omapatrilat and enalapril in patients with hypertension:the Omapatrilat Cardiovascular Treatment vs Enalapril (OCTAVE) trial // Am. J. Hypertens. 2004. Vol. 17. P. 103-111.
9. Azizi M., Bissery A., Peyrard S. et al. Pharmacokinetics and pharmacodynamics of the vasopeptidase inhibitor AVE7688 in humans // Clin. Pharmacol. Ther. 2006. Vol. 79. P. 49-61.
10. Gu J., Noe A., Chandra P. et al. Pharmacokinetics and pharmacodynamics of LCZ696, a novel dualacting angiotensin receptorneprilysin inhibitor (ARNi) // J. Clin. Pharmacol. 2010. Vol. 50. P. 401-414.
11. Ruilope L.M., Dukat A., Buhm M. et al. Bloodpressure reduction with LCZ696, a novel dualacting inhibitor of the angiotensin II receptor and neprilysin: a randomised, double-blind, placebo-controlled, active comparator study // Lancet. 2010. Vol. 375. P. 1255-1266.
12. Solomon S.D., Zile M., Pieske B. et al. The angiotensin receptor neprilysin inhibitor LCZ696 in heart failure with preserved ejection fraction: a phase 2 double-blind randomised controlled trial // Lancet. 2012. Vol. 380(9851). P. 1387-1395.
13. Levin E.R. Endothelins // N. Engl. J. Med. 1995. Vol. 333. P. 356-363.
14. Dhaun N., Goddard J., Kohan D.E. et al. Role of endothelin-1 in clinical hypertension: 20 years on // Hypertension. 2008. Vol. 52. P. 452-459.
15. Burnier M., Forni V. Endothelin receptor antagonists: a place in the management of essential hypertension? // Nephrol. Dial. Transplant. 2011. 0: 1-4. doi: 10.1093/ndt/gfr704.
16. Krum H., Viskoper R.J., Lacourciere Y. et al. The effect of an endothelin-receptor antagonist, bosentan, on blood pressure in patients with essential hypertension. Bosentan Hypertension Investigators // N. Engl. J. Med. 1998. Vol. 338. P. 784-790.
17. Weber M.A., Black H., Bakris G. et al. A selective endothelin-receptor antagonist to reduce blood pressure in patients with treatment-resistant hypertension: a randomised, double-blind, placebo-controlled trial // Lancet. 2009. Vol. 374. P. 1423-1431.
18. Bakris G.L., Lindholm L.H., Black H.R. et al. Divergent results using clinic and ambulatory blood pressures: report of a darusentan-resistant hypertension trial // Hypertension. 2010. Vol. 56. P. 824-830.
19. Mann J.F., Green D., Jamerson K. et al. Avosentan for overt diabetic nephropathy // J. Am. Soc. Nephrol. 2010. Vol. 21. P. 527-535.
20. Kalk P., Sharkovska Y., Kashina E. et al. Endothelinconverting enzyme/neutral endopeptidase inhibitor SLV338 prevents hypertensive cardiac remodeling in a blood pressure-independent manner // Hypertension. 2011. Vol. 57. P. 755-763.
21. Nussberger J., Wuerzner G., Jensen C. et al. Angiotensin II suppression in humans by theorally active renin inhibitor Aliskiren (SPP100): comparison with enalapril // Hypertension. 2002. Vol. 39(1). P. E1-8.
22. Alreja G., Joseph J. Renin and cardiovascular disease: Wornout path, or new direction? // World J. Cardiol. 2011. Vol. 3(3). P. 72-83.
23. Ingelfinger J.R. Aliskiren and dual therapy in type 2 diabetes mellitus // N. Engl. J. Med. 2008. Vol. 358(23). P. 2503-2505.
24. Pouleur A.С., Uno H., Prescott M.F., Desai A. (for the ALLAY Investigators). Suppression of aldosterone mediates regression of left ventricular hypertrophy in patients with hypertension // J. Renin-Angiotensin-Aldosterone System. 2011. Vol. 12. P. 483-490.
25. Kelly D.J., Zhang Y., Moe G. et al. Aliskiren, a novel renin inhibitor, is renoprotective in a model of advanced diabetic nephropathy in rats // Diabetol. 2007. Vol. 50. P. 2398-2404.
Альдостерон у человека является основным представителем минералокортикоидных гормонов, производных холестерола.
Синтез
Осуществляется в клубочковой зоне коры надпочечников. Образованный из холестерола прогестерон на пути к альдостерону подвергается последовательному окислению 21-гидроксилазой, 11-гидроксилазой и 18-гидроксилазой . В конечном итоге образуется альдостерон.

Схема синтеза стероидных гормонов (полная схема)
Регуляция синтеза и секреции
Активируют :
- ангиотензин II , выделяемый при активации ренин-ангиотензиновой системы,
- повышение концентрации ионов калия в крови (связано с деполяризацией мембран, открытием кальциевых каналов и активацией аденилатциклазы).
Активация ренин-ангиотензиновой системы
- Для активации этой системы существует два пусковых момента:
- снижение давления в приносящих артериолах почек, которое определяется барорецепторами клеток юкстагломерулярного аппарата. Причиной этого может быть любое нарушение почечного кровотока – атеросклероз почечных артерий, повышенная вязкость крови, обезвоживание, кровопотери и т.п.
- снижение концентрации ионов Na + в первичной моче в дистальных канальцах почек, которое определяется осморецепторами клеток юкстагломерулярного аппарата. Возникает в результате бессолевой диеты, при длительном использовании диуретиков.
Постоянная и независимая от почечного кровотока секреция ренина (базовая) поддерживается симпатической нервной системой.
- При выполнении одного или обоих пунктов клетки юкстагломерулярного аппарата активируются и из них в плазму крови секретируется фермент ренин .
- Для ренина в плазме имеется субстрат – белок α2-глобулиновой фракции ангиотензиноген . В результате протеолиза от белка отщепляется декапептид под названием ангиотензин I . Далее ангиотензин I при участии ангиотензин-превращающего фермента (АПФ) превращается в ангиотензин II .
- Главными мишенями ангиотензина II служат гладкие миоциты кровеносных сосудов и клубочковая зона коры надпочечников:
- стимуляция кровеносных сосудов вызывает их спазм и восстановление артериального давления .
- из надпочечников после стимуляции секретируется альдостерон , действующий на дистальные канальцы почек.
При воздействии альдостерона на канальцы почек увеличивается реабсорбция ионов Na + , вслед за натрием движется вода . В результате давление в кровеносной системе восстанавливается и концентрация ионов натрия увеличивается в плазме крови и, значит, в первичной моче, что снижает активность РААС.

Активация ренин-ангиотензин-альдостероновой системы
Механизм действия
Цитозольный.
Мишени и эффекты
Воздействует на слюнные железы, на дистальные канальцы и собирательные трубочки почек. В почках усиливает реабсорбцию ионов натрия и потерю ионов калия посредством следующих эффектов:
- увеличивает количество Na + ,K + -АТФазы на базальной мембране эпителиальных клеток,
- стимулирует синтез митохондриальных белков и увеличение количества нарабатываемой в клетке энергии для работы Na + ,K + -АТФазы,
- стимулирует образование Na-каналов на апикальной мембране клеток почечного эпителия.
Патология
Гиперфункция
Синдром Конна (первичный альдостеронизм) – возникает при аденомах клубочковой зоны. Характеризуется триадой признаков: гипертензия, гипернатриемия, алкалоз.
Вторичный гиперальдостеронизм – гиперплазия и гиперфункция юкстагломерулярных клеток и избыточная секреция ренина и ангиотензина II. Отмечается повышение артериального давления и появление отеков.
Ренин
– фермент, синтезируемый юкстагломерулярными клетками почечных афферентных артериол, имеющий ММ около 40 кДа. Особенно интенсивно образование ренина происходит при ишемии почек. Локализация юкстагломерулярных клеток делает их особенно чувствительными к изменениям кровяного давления, а также концентрации ионов Na + и К + в жидкости, протекающей через почечные канальцы. Благодаря указанным свойствам любая комбинация факторов, вызывающая снижение объема жидкости (обезвоживание, падение кровяного давления, кровопотеря и др.) или снижение концентрации NaCl, стимулирует высвобождение ренина.
В то же время большинство регуляторов синтеза ренина действуют через почечные барорецепторы. На освобождение ренина оказывает влияние состояние ЦНС, а также изменение положения тела в пространстве. В частности, при переходе из положения лёжа в положение сидя или стоя (клиностатическая проба) секреция ренина увеличивается. Эта рефлекторная реакция обусловлена повышением тонуса симпатической части автономной нервной системы, передающей импульсы к b-адренорецепторам юкстагломерулярных клеток.
Основным субстратом, на который воздействует ренин, является ангиотензиноген – белок, входящий во фракцию a 2 -глобулинов и образуемый печенью. Под воздействием глюкокортикоидов и эстрогенов синтез ангиотензиногена значительно возрастает. В результете действия ренина ангиотензиноген превращается в декапептид ангиотензин I. Это соединение обладает чрезвычайно слабым действием и существенного влияния на уровень кровяного давления не оказывает.
Между тем ангиотензин I под воздействием так называемого ангиотензинпревращающего фермента (АПФ) переходит в мощный сосудосуживающий фактор – ангиотензин II. АПФ (дипептидкарбооксипептидаза) является интегральным белком, расположенным преимущественно на мембране эндотелиальных клеток, эпителии, мононуклеарах, нервных окончаниях, клетках репродуктивных органов и др. Растворимая форма АПФ присутствует практически во всех жидкостях организма.
Принято выделять две изоформы АПФ. Первая из них получила условное наименование «соматической». Эта изоформа имеет ММ 170 кДа и включает гомологичные С- и N-домены. Вторая форма АПФ («репродуктивная») найдена в семенной жидкости, имеет ММ около 100 кДа и соответствует С-домену первой изоформы АПФ. Каждый из 2 указанных доменов содержит аминокислотные остатки, которые могут принимать участие в образовании связи с атомом цинка. Такие Zn 2+ -структуры являются типичными для многих металлопротеиназ и оказываются основными участками взаимодействия фермента как с субстратом, так и с ингибиторами АПФ.
Следует заметить, что АПФ не только приводит к образованию ангиотензина II, но и разрушает брадикинин – соединение, расширяющее кровеносные сосуды. Следовательно, увеличение кровяного давления при воздействии АПФ связано как с образованием ангиотензина II, так и с распадом брадикинина (рис. 32).
Важную роль для действия АПФ играет ионный состав и, в частности, содержание ионов хлора. Так, при высокой концентрации Cl – С-домен АПФ гидролизует и брадикинин, и ангиотензин-I быстрее, чем N-домен. Во внеклеточных регионах, где концентрация анионов хлора высока, за превращение ангиотензина-I отвечает преимущественно N-домен. Однако внутриклеточно, где концентрация Cl – низкая, N-домен может участвовать в гидролизе других пептидных субстанций.
За последние годы установлено, что АПФ играет важную роль в гемопоэзе, ибо под его воздействием ингибируется образование гематопоэтического пептида , тормозящего образование гематопоэтических клеток костного мозга.
Роль АПФ в организме была выявлена на мышах, лишенных гена АПФ. У таких животных отмечалось низкое кровяное давление, различные сосудистые дисфункции, нарушение структуры и функции почек и бесплодие у самцов.
Ангиотензин II
увеличивает кровяное давление, вызывая сужение артериол, и является самым сильнодействующим из известных вазоактивных агентов. Кроме того, он по механизму обратной связи тормозит образование и высвобождение ренина юкстагломерулярными клетками почки, что в конечном итоге должно восстанавливать нормальный уровень кровяного давления. Под воздействием ангиотензина II резко возрастает продукция основного минералокортикоида – альдостерона. Несмотря на то, что это действие является прямым, ангиотензин II не влияет на продукцию кортизола. Основное назначение альдостерона сводится к задержке Na + (за счет усиления его реабсорбции в почечных канальцах) и выделению К + и Н + (главным образом через почки). Эти реакции осуществляются следующим образом.
Альдостерон
проникает из внеклеточной жидкости в цитоплазму клетки и там соединяется со специфическим рецептором, после чего образовавшийся комплекс (альдостерон+рецептор) проникает в ядро. Альдостерон также стимулирует открытие Na + каналов, благодаря чему ионы Na + входят в клетку через апикальную мембрану из просвета канальца.
Увеличение секреции К + под воздействием альдостерона обусловлено возрастанием проницаемости апикальной мембраны по отношению к этим ионам, благодаря чему К + поступает из клетки в просвет канальца.
Задержка Na + в организме, как и ангиотензин II, способствует повышению кровяного давления.
Ангиотензин II способен связываться со специфическими рецепторами клубочковых клеток надпочечника. Содержание этих рецепторов во многом зависит от концентрации ионов К + . Так, если уровень К + повышается, то возрастает число рецепторов к ангиотензину II в клубочковых клетках. При уменьшении концентрации ионов К + отмечается прямо противоположный эффект. Следовательно, ионы К + играют основную роль в действии ангиотензина II на надпочечники.
За последнее время установлено, что ангиотензин II способен активировать макрофаги, благодаря чему усиливается агрегация тромбоцитов и ускоряется свёртывание крови. Одновременно при этом высвобождается ингибитор активатора плазминогена- I (ИАП-1), что может сопровождаться депрессией фибринолиза. Ангиотензин II является одним из факторов, способствующих развитию атерогенеза, торможению апоптоза и усилению оксидативного стресса в тканях, тем самым провоцируя агрегацию тромбоцитов и тромбообразование.
Ангиотензин II способен усиливать функцию миокарда, участвует в биосинтезе норадреналина и других физиологически активных веществ. Одновременно он может действовать как ростовой фактор, приводя к сосудистой и сердечной гипертрофии.
У некоторых животных и у человека ангиотензин II под воздействием фермента аминопептидазы превращается в гептапептид ангиотензин III. У человека уровень ангиотензина II приблизительно в 4 раза выше, чем ангиотензина III. Оба эти соединения оказывают влияние на уровень кровяного давления и продукцию альдостерона и довольно быстро разрушаются под воздействием ферментов ангиотензиназ.
При тяжелых заболеваниях почек, сопровождающихся их ишемией, благодаря повышенному образованию и секреции ренина наблюдается стойкое повышение кровяного давления (почечная гипертензия). Применение ингибиторов АПФ в этих условиях приводит к быстрой нормализации кровяного давления.
В заключение следует еще раз подчеркнуть, что ангиотензин-ренино-альдостероновая система теснейшим образом связана с функцией калликреин-кининовой системы, ибо образование ангиотензина II и разрушение брадикинина осуществляется под воздействием одного и того же фермента – АПФ.
